近日,物理与光电工程学院(理工学院)关柏鸥教授团队提出一种基于光纤的药物递送与光控药物释放策略,将药物直接送达深部病灶,实现了肿瘤光热与抗肿瘤药物协同治疗。该策略不仅提供了一种精准直接、高效能的肿瘤协同治疗方法,还为药物研发提供了一种全新高效的药效评价与筛选平台。研究成果以“Fiber-optic drug delivery strategy for synergistic cancer photothermal-chemotherapy”为题,于2024年9月3日发表在Light: Science & Applications(影响因子20.6)上。该项研究由暨南大学独立完成,硕士研究生张永康为论文第一作者,关柏鸥教授与冉洋教授为共同通讯作者,生命科学技术学院王一飞教授和钟文彬教授、临床医学院李承志主任和曹东林主任做出了贡献。
传统化疗方式将抗肿瘤药物通过体循环系统进行递送,不仅药物递送效率低下,而且药物在循环过程中不可避免地对正常器官和组织造成损害。药物控制释放策略可以有效地克服上述问题,因此受到了广泛关注。其中,光热驱动药物释放策略不仅能够在对正常组织器官低损伤的情况下实现药物可控性释放,还能利用局部热疗引起肿瘤微环境变化,促进肿瘤组织对药物的吸收,极具应用前景。然而,生物组织对光的强烈吸收与散射,使得光热药物释放策略的治疗深度受到了严重限制。此外,在治疗过程中缺少温度和药物释放剂量的监控手段,也阻碍了其在药物研究与临床上的应用。
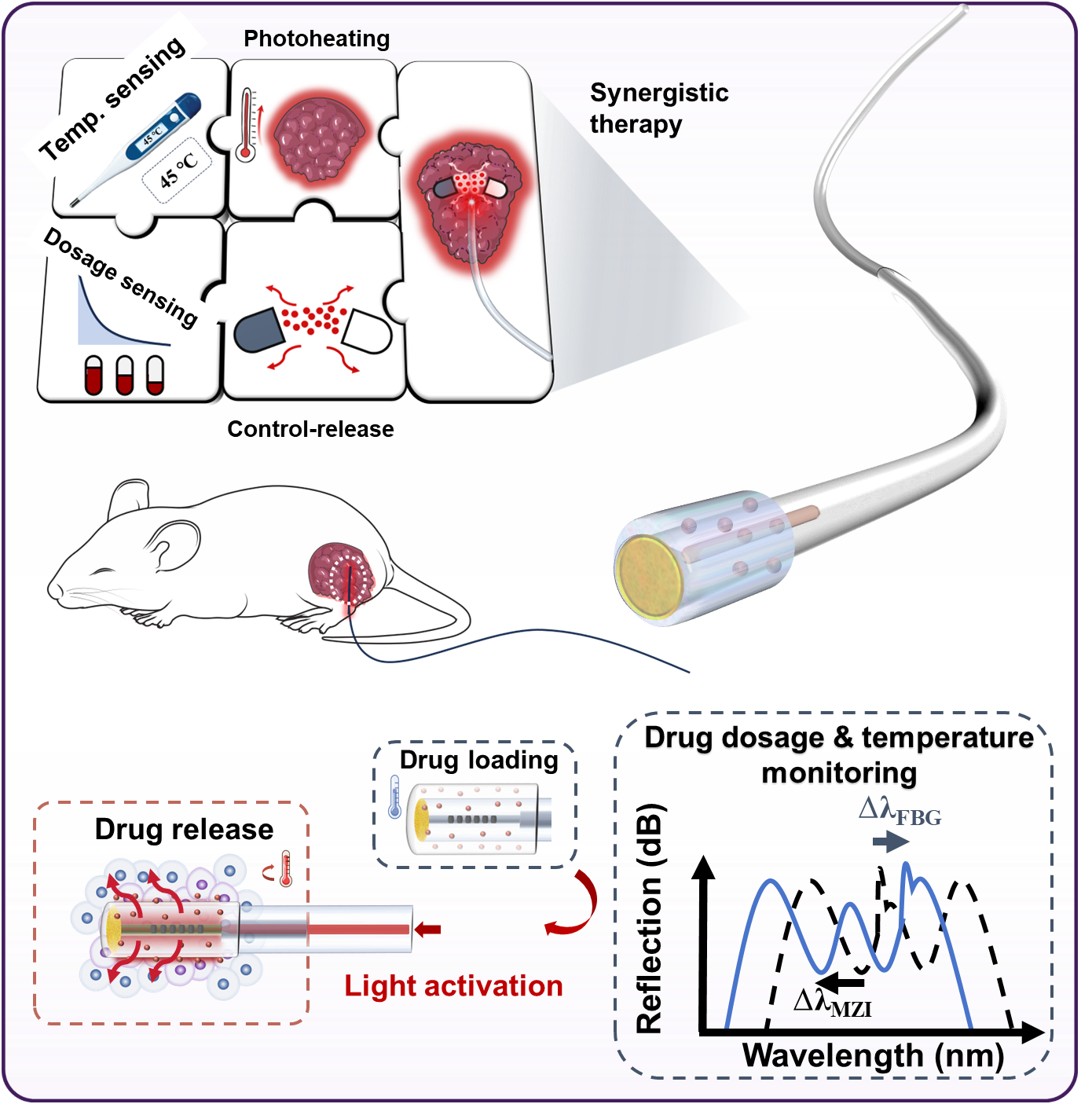
图1.基于光纤光控药物释放的肿瘤光热化疗协同治疗策略示意图
针对上述难题,团队以光纤作为药物递送载体,利用生物可降解的温控相变琼脂糖水凝胶将抗肿瘤药物包裹于光纤表面,通过光纤介入的方法直接将药物递送到肿瘤病灶,在病灶处通过光纤光热效应引发凝胶相变实现药物的原位释放,如图1所示。该方案不仅不受光学穿透深度的限制,而且避免了传统化疗方式药物经体循环带来的代谢损失和生物毒性。利用肿瘤组织的热耐受能力较差以及热刺激下微环境变化等特点,该方案对肿瘤部位的光热效应不仅可以直接杀伤肿瘤细胞,还能增加肿瘤组织的通透性,促进肿瘤组织对药物的吸收,巧妙地实现了光热化疗协同治疗。
如图1所示,借助光纤丰富的设计自由度,还能够在光纤载药探针中集成传感器进行温度和药物释放剂量监测,实现探针的多功能模块。研究团队利用光纤布拉格光栅(FBG)传感器实时监测病灶处温度变化(图2),利用基于反射式多模-单模光纤结构的在线集成式马赫-曾德干涉仪(MZI)折射率传感器实时监测药物浓度剂量(图2),实现了光热药物释放与治疗的全过程实时监控。
由于光纤载药探针尺寸小巧,可以深入到肿瘤中心位置进行药物释放,实现了一种全新的“中央-外周”肿瘤药物扩散释放机制,从而增强药物的渗透性和滞留性。此外,在治疗过程中部分琼脂糖水凝胶颗粒将会形成分散的小颗粒结构,其内部仍然包裹着抗肿瘤药物,这些载药凝胶颗粒会在肿瘤患处长时间停留,并继续通过生物降解缓释药物,保持治疗的长期性与持续性,最终实现对于肿瘤细胞的全面清除。该治疗探针在活体实验中通过快速主动释放与缓释结合治疗达到了良好的肿瘤治疗效果。如图2所示,治疗组小鼠的肿瘤增长得到了很好的抑制效果,且创口在进行治疗后21天基本恢复。
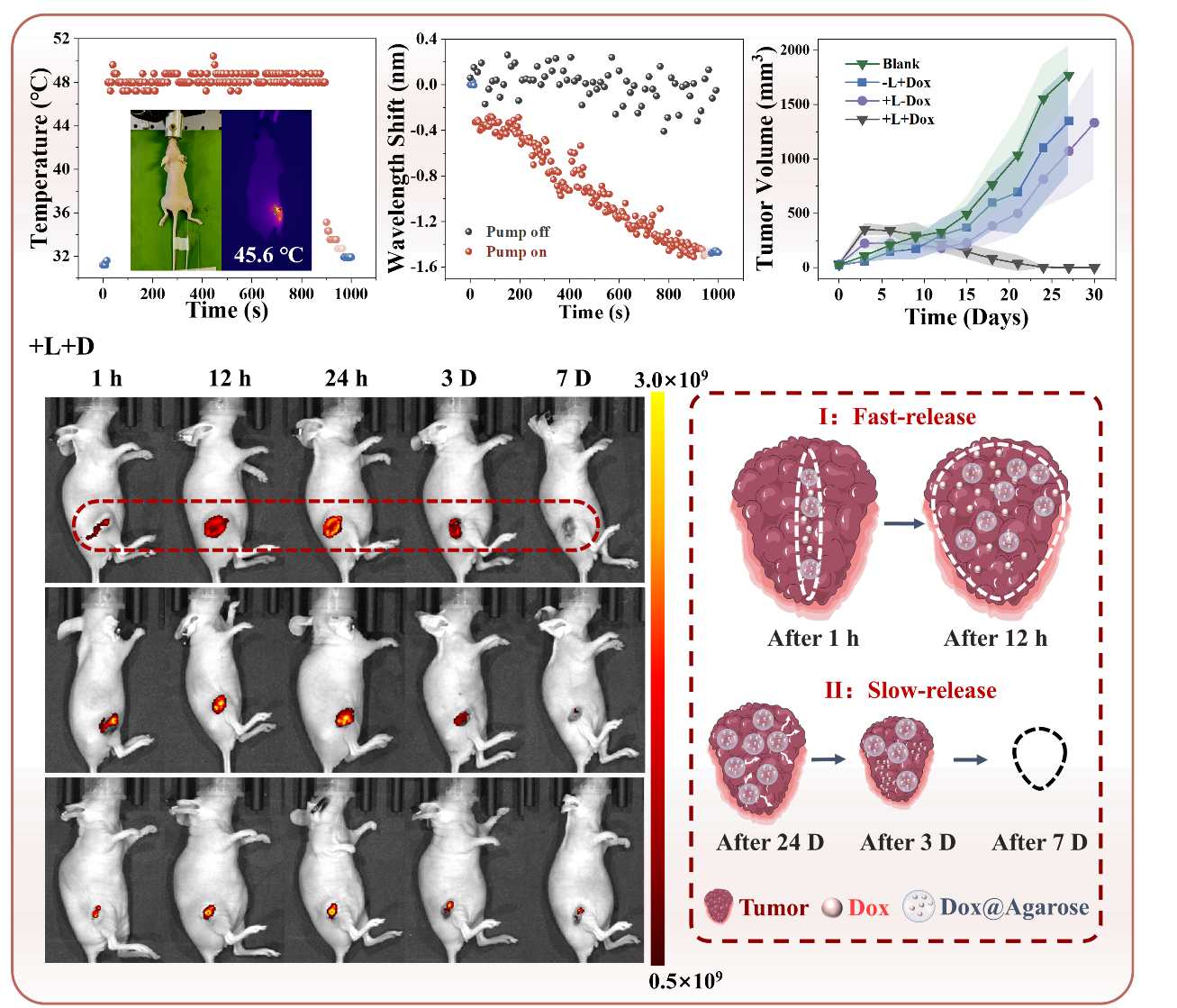
图2.基于光纤的多功能肿瘤治疗探针活体实验与治疗机制探索
该治疗策略在制药领域应用上拥有巨大潜力。全球每年有超过90%的候选药物无法通过临床的批准。其中,由于体循环毒性以及动物模型间药物响应差异的因素而失败的药物占到了三成。基于光纤的药物递送系统直接将药物精准送达病灶,有效避开了体循环代谢系统,能够消除动物模型间药物响应差异,为抗肿瘤药物的评估与筛选提供一个全新且高效的按需给药平台策略,为药物开发提供更加有效的评估手段。
该工作得到了国家自然科学基金重点项目(62335010)、“广东特支计划”本土创新创业团队项目(2019BT02X105)、中央高校基本科研业务费专项资金(21623203)等项目的资助。
文章链接:https://doi.org/10.1038/s41377-024-01586-z
图文:冉洋
校对:杨嘉琳
责任编辑:邓玉萌
初审:肖艳芳
复审:孙玉环
终审发布:黄睿

